モル計算は単位を見れば勝手に解ける!
モル計算って、公式覚えて、当てはめて…ってやり方が一般的ですが、なんだかモヤモヤすることはありませんか?
数字は出せても、なぜその式になるのか理解できずに、途中で単位を混同してしまい、ミスをしてしまうことも多いと思います。私も最初はそうでした。
しかし、「単位で考える」という意識を持つだけで、モル計算は驚くほどすっきり理解できるようになります。公式をただ覚えるでけでなく、「この単位を別の単位に変換しているだけだ」と考えることで、計算の意味が自然と見えてくるのです。むしろ、「単なる単位の変換だったのか」と驚くかもしれません。
そこでこの記事では、モル計算を「難しい計算」として捉えるのではなく、単位の変換として考える視点をお伝えしたいと思います。
モル計算は単位の変換!
例題 質量18gのH₂Oのmolは何か?
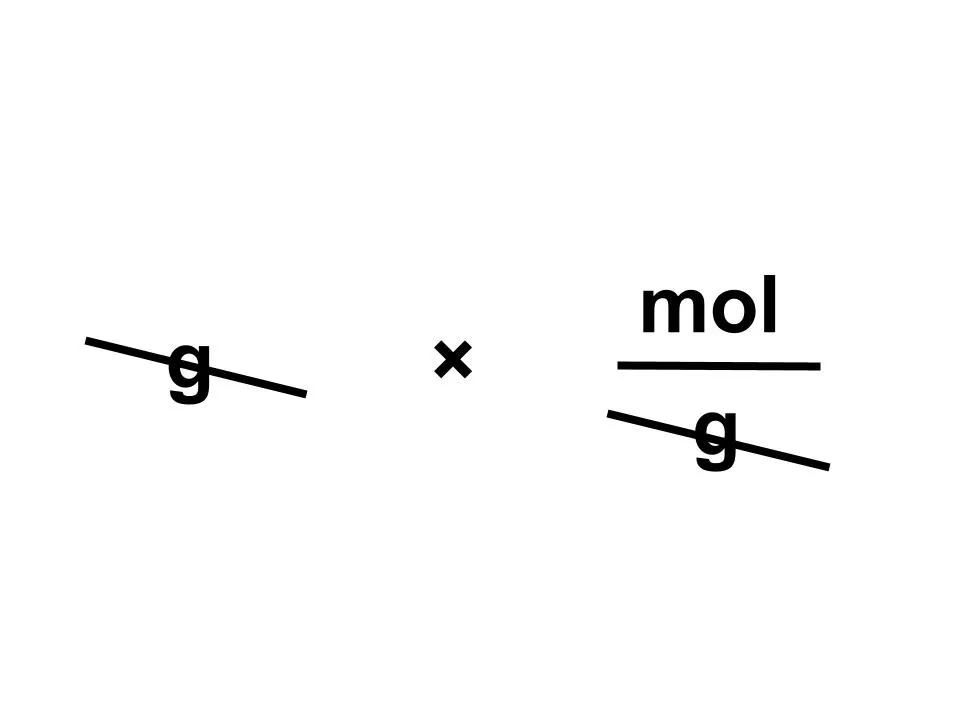
よく知られている公式では、モル数は「質量〔g〕÷分子量〔g/mol〕」で求めます。この場合、水の分子量は18g/molですから、18÷18で1となります。
しかし、単に数字を計算しているだけでは、なぜこの式になるのか理解しづらいかもしれません。そこで、単位に注目してみます。
与えられているのは、18〔g〕と18〔g/mol〕です。ではどのようにmolが求められるのか考えていきましょう。
POINT1 先に単位を計算する!
求めたいのはmolです。gとg/molからどのようにしたらmolが出てきますか?
そのまま、g×g/molではg^2/molと訳のわからない単位になりますね。
では逆数(÷)にすると...
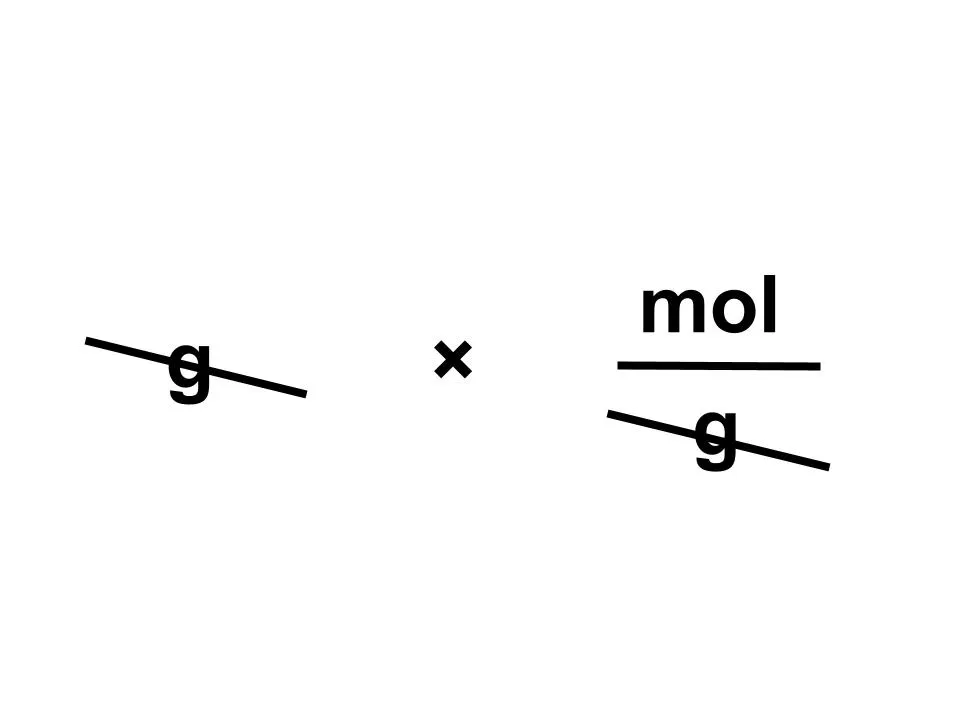
g×mol/gとなりgが約分できます。これで求めたいmolが出てきました。
なので「質量〔g〕÷分子量〔g/mol〕=mol」が成り立つので、
POINT2 単位が全て消えるとき
では、粒子の個数はどのように求めますか? 公式では、「mol×アボガドロ定数〔/mol〕です。
これを単位のみの式にするとこうなります。
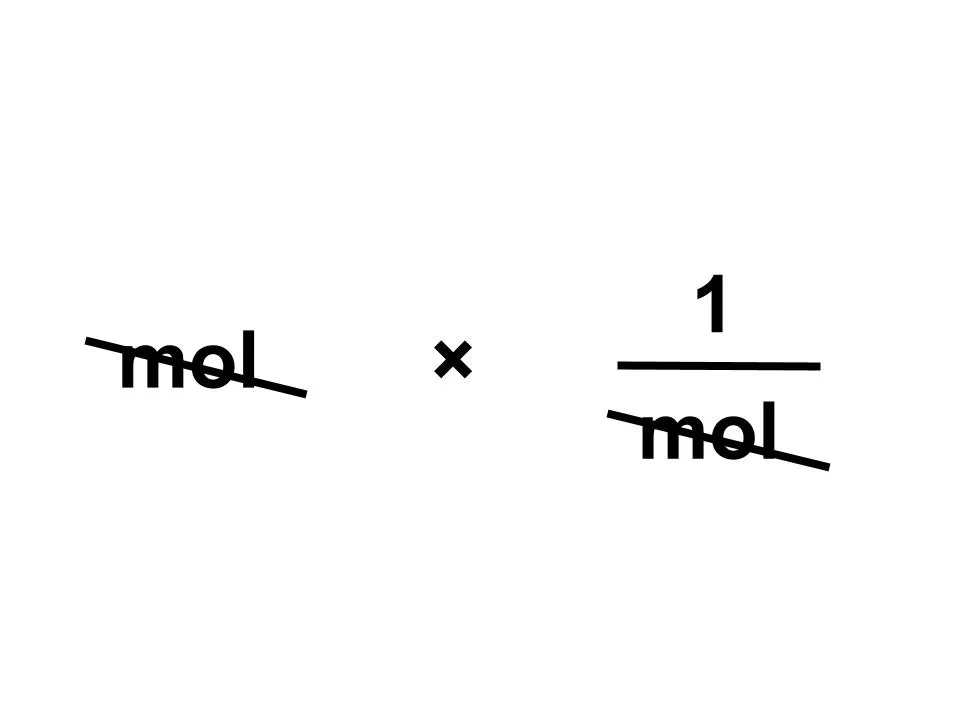
molが約分されて単位がなくなりました。「え?これいいの?」と思うかもしれませんが実はOKです。単位が消えたときは、それが「何個あるか」を示す粒子の個数だと考えて問題ありません。
補足:教科書や問題集によって、アボガドロ定数の単位は〔個/mol〕や〔/mol〕と異なることがありますが意味することは同じです。
では、これまでの知識を使って下の練習問題を解いてみましょう。
練習問題
(H=1.0、C=12、O=16)
(1)3.2gのメタノールCH₄Oのmolは?また、含まれる水素の質量は?
(2)3.6gのグルコースC₆H₁₂O₆を水に溶かして400mLとした水溶液のモル濃度〔mol/L〕は?
解答・解説
(1)(i)メタノールのモル質量は32g/molです。molを求めたいから...
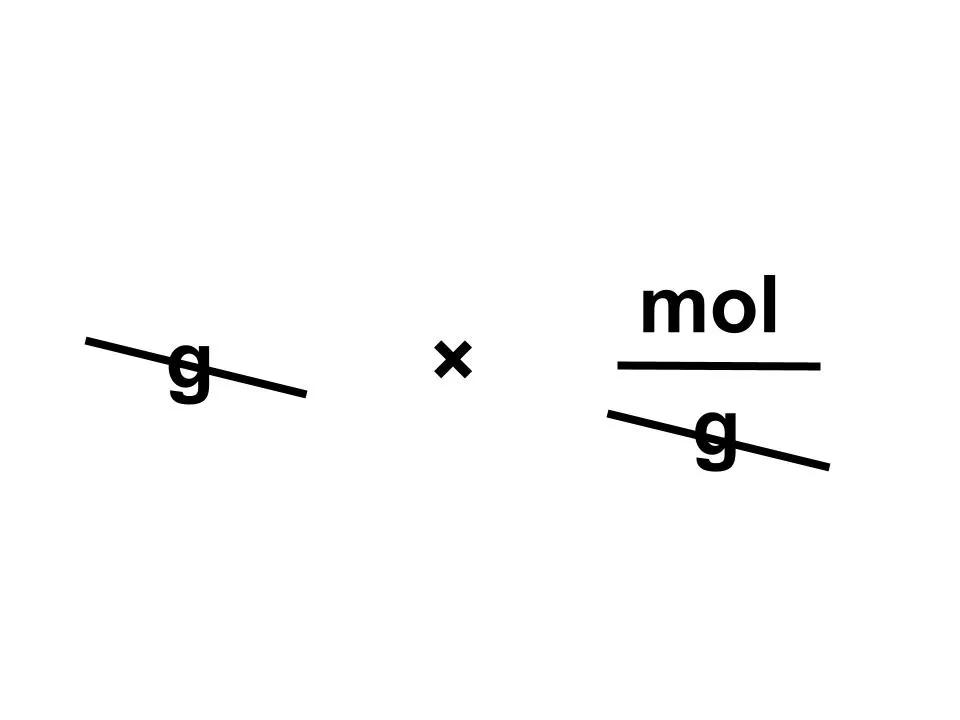
よって質量〔g〕÷分子量〔g/mol〕=mol
(ii)水素はメタノール1つ中に4つ含まれるからメタノール1molには水素4molある。
メタノールは(i)0.10molなので水素は0.10×4=0.40mol
求めたいのは質量gです。与えられているのはg/molとmolで水素のモル質量は1.0g/molなので...
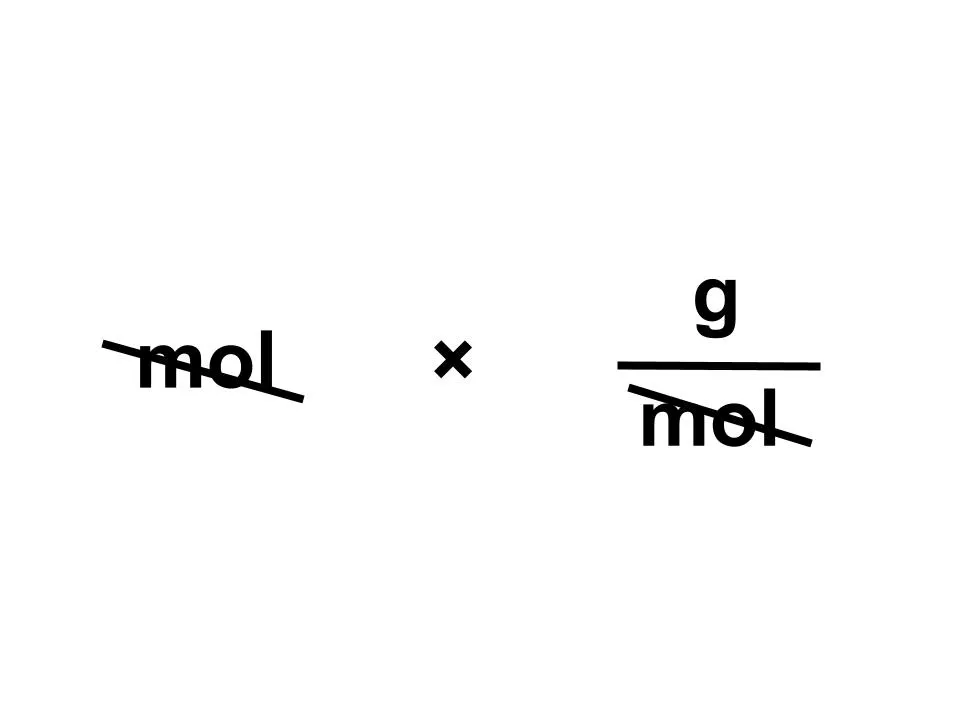
与えられているのはグルコース3.6gでモル質量は180g/molです。molを求めると...
まとめ
モル計算って聞くと、難しそうに感じますが、「単位の変換」を意識することでわかりやすくなります。
gをmolに変えるときはモル質量で割る、molをLで割ればモル濃度になる。このように、単位が次に何をすればいいか教えてくれるんです。式を覚えようとすると混乱しやすいですが、単位の流れをたどるだけならどんな問題にも応用がききます。
「数字よりも単位を見る」──これを意識するだけでモル計算が驚くほどすっきりして見えるはずです。
モル計算は、式じゃなく単位が導く。